|
 |
Bentuk Molekul
Uraian
Bentuk molekul merupakan gambaran secara teoritis susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron ikatan dan pasangan elektron bebas atom pusat. Susunan atom-atom teratur menurut pola-pola tertentu. Pola-pola itu disebut dengan bentuk molekul.
Teori yang sederhana untuk menjelaskan bentuk molekul yang mengandung ikatan pasangan elektron adalah teori tolakan pasangan elektron dalam kulit valensi atau teori VSEPR (Valence Shell Electron Pair Repulsion). Menurut teori ini, bangun suatu molekul ditentukan oleh pasangan elektron yang terdapat dalam kulit valensi atom pusat. Pasangan-pasangan elektron akan saling menjauhi agar tolak menolak antara pasangan-pasangan elektron terjadi seminimal mungkin.
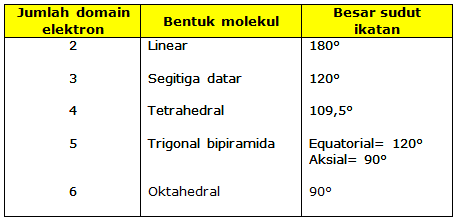
Teori VSEPR kemudian disempurnakan melalui teori domain elektron yang mampu memprediksi bentuk molekul secara ideal berdasarkan eksistensi domain elektron ikatan dan domain elektron bebas. Berdasarkan teori domain elektron terdapat lima macam bentuk dasar molekul kovalen, yaitu: linear, segitiga datar, tetrahedral, trigonal bipiramida, dan oktahedral.
- Menentukan Domain Elektron dalam Suatu Senyawa
Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron, dengan jumlah domain ditentukan sebagai berikut:
- Setiap elektron ikatan (baik itu ikatan tunggal, rangkap, atau rangkap tiga) berarti 1 domain.
- Setiap pasangan elektron bebas berarti 1 domain. Untuk lebih jelasnya, silahkan Anda simak animasi penentuan domain elektron untuk molekul CH4 berikut ini.
- Mengasosiasikan Teori Domain Elektron dengan Bentuk Molekul
Atom-atom dalam berikatan untuk membentuk molekul melibatkan alektron-elektron pada kulit terluar. Ikatannya terbentuk karena pemakaian bersama pasangan elektron (ikatan kovalen). Oleh sebab itu bentuk molekul ditentukan oleh kedudukan pasangan-pasangan elektron tersebut. Di dalam molekul senyawa umumnya terdapat atom yang dianggap sebagai atom pusat. Misalnya pada senyawa H2O sebagai atom pusat adalah atom oksigen dan pada molekul PCl3 atom fosforus sebagai atom pusatnya. Pasangan elektron yang berada pada di sekitar atom pusatnya dapat dibedakan menjadi dua, yakni pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB). Pasangan elektron bebas mempunyai gaya tolak yang lebih besar dari pada pasangan elektron ikatan. Hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom sehingga gerakannya lebih leluasa.
Teori domain elektron mempunyai prinsip-prinsip dasar sebagai berikut:
- Antar domain elektron pada kulit luar atom pusat saling tolak-menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum.
- Urutan kekuatan tolak-menolak di antara domain elektron adalah:
Tolakan antar domain elektron bebas
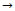 tolakan antara domain elektron bebas dengan domain elektron ikatan
tolakan antara domain elektron bebas dengan domain elektron ikatan 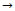 tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap tiga, yang pasti mempunyai daya tolak lebih besar daripada domain yang hanya terdiri dari sepasang elektron.
tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap tiga, yang pasti mempunyai daya tolak lebih besar daripada domain yang hanya terdiri dari sepasang elektron. - Bentuk molekul hanya ditentukan oleh pasangan elektron terikat. Perhatikan tabel berikut!
Tabel Susunan Ruang Domain Elektron
Yang Menghasilkan Tolakan Minimum
Jumlah domain elektron dalam suatu molekul diberi notasi khusus untuk menunjukkan jumlah PEI dan PEB, yaitu :
![]()
Dimana A = atom pusat, X = PEI, E = PEB, n = jumlah masing-masing PEI/PEB
![]()